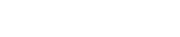什么是肺小结节 肺小结节影像学筛查方法
在世界范围内,肺癌是发病率与病死率最高的恶性肿瘤[1-2]。我国情况相似,最新癌症数据显示, 2020年我国新发肺癌约82万例,死亡71万例,新发及死亡人数均居恶性肿瘤之首[1]。面对吸烟、空气污染、人口老龄化加剧等严峻形势,我国肺癌发病率和病死率呈上升趋势[3-5]。
近年来,肺癌治疗取得了较大进展,我国肺癌的5 年生存率也从 16.1%(2003—2005)提高到19.7%(2012—2015)[6],但仍有约75%的患者在诊断时已处于肺癌晚期,错过了最佳根治性治疗时机[7]。
肺癌早筛早诊的意义
提高肺癌生存率的关键在于早期发现、早期诊断和早期治疗,而早期诊断又是重中之重。研究显示早期诊断并且完全切除的原位腺癌(adenocarcinoma in situ,AIS)和微浸润腺癌(minimally invasive adenocarcinoma,MIA),10 年疾病特异性生存率分别为 100% 和 100%,总生存率分别为 95.3% 和 97.8%[10],而I期浸润性腺癌完全切除后的 5 年复发率高达10%~30%[11-13]。
我国开展的社区肺癌高危人群低剂量胸部 CT(LDCT)筛查结果显示,肺结节阳性率高达22.9%(804/3 512),其中恶性结节患者比例达6.34%(51/804),肺癌检出率为1.5% (51/3 512)[9]。
什么是肺小结节
肺小结节通常指直径小于3 cm的肺内结节性病灶,其具体又可以分为实性结节和部分实性结节,在临床鉴别诊断中较为常见,主要包括良性 结节和恶性结节[14]。其中,良性结节主要为肺部感染炎症所致,其中约80%以上为肉芽肿,小部分可能是错构瘤(约占10%),动脉瘤和动静脉畸形较为少见[15]。恶性结节中约80%为原发性肺癌,小部分是孤立性转移瘤,还有少量的类癌和淋巴瘤[16]。
由于实性结节癌变的概率极高,所以正确诊断肺小结节的性质,对肺小结节患者的后期治疗和生存至关重要。
来源:网络
肺小结节影像学筛查
1、低剂量CT(low‐dose computed tomography, LDCT):可以有效地发现早期肺癌,已经取代胸部 X 线成为敏感的肺癌筛查工具。对于胸部LDCT检查结果的报告,尤其是对于肺结节的报告,建议采用 Lung‐RADS 标准[8],详细描述肺结节的数量、位置、大小、密度、形态、边缘、内部是否含有脂肪或钙化等特征。肺结节的恶性概率与结节密度、大小、形态、位置和生长速度等多种因素密切相关。为了准确评 估基线 LDCT 检出的肺结节的恶性风险,需参照肺结节处理指南[17]进行肺结节风险评估。
2、高分辨率CT(high resolution computed tomography,HRCT):薄层CT重建影像技术可更好地显示直径<5 mm 的微小结节、中央气道内和第 6、 7 级支气管和小血管,能更加敏感地发现微小肺结节并且明确病灶与周围气道和血管的关系。
3、磁共振成像(magnetic resonance imaging,MRI)检查:MRI中的常用序列弥散加权成像 (diffusion weighted imaging,DWI)是在传统的成像 基础上衍生出来的一种技术,采用快速反转恢复平面回波成像(short T1 inversion recovery echo‐planar imaging ,STIR‐EPI ) ,在自由呼吸状态下完成扫描 , 将正常的血管、脂肪、肌肉、肠道等组织背景信号抑制后,得到高信噪比、高分辨率和高对比度的图像[18]。考虑到图像分辨率等因素,对于实性肺结节且难以接受放射性检查的患者,DWI‐MRI或可作为LDCT或PET‐CT的补充检查手段[19]。此外,DWI‐MRI对于青少年患者及需要反复行影像学检查的患者具有潜在优势。但DWI‐MRI对于纯磨玻璃结节、微小亚实性结节和亚厘米实性结节,敏感度尚不理想。
4、正电子发射计算机断层显像(positron emission tomography‐computed tomography,PET‐CT)检查:PET‐CT 在肺癌的诊断、分期、治疗评价中具有较高的敏感度和特异度。对于结节直 径≥8 mm 的实性结节或部分实性结节持续存在且内部实性成分≥8 mm 者,根据患者情况可推荐使用 PET‐CT 进一步判断结节性质;需要注意的是, PET‐CT 对于纯磨玻璃结节、实性成分<8 mm 的亚实性结节和靠近膈肌的小结节敏感度较低,另外在 肺结核等感染性肺病流行的地区,PET‐CT 的鉴别能力较低[20,21]。我国肺结核发病率高于西方发达国家,因此在应用 PET‐CT 诊断肺癌时,需要鉴别肺结核等感染性肉芽肿。
5、人工智能(artificial intelligence,AI)辅助影像诊断:是通过计算机、生命科学、临床医学等技术手段使机器具备感知、分析、推理和决策等人类智能的能力和功能。人工智能对肺部病灶的检出方面非常快捷,但仍有一定的假阴性率,需要人工阅片确认以减少漏诊。人工智能在用于判断病灶恶性风险时,可为临床提供辅助依据,但目前仍无法替代人工诊断[22-23]。
小结
肺小结节的早期检查和诊断对与肺癌治疗及患者生存率具有十分重要的作用,随着医学影像学的快速发展,肺小结节影像学检查技术已经渐趋成熟,能帮助患者更加准确的掌握肺小结节的性质,既能减轻肺小结节患者的精神压力,还能提示肺小结节恶性患者尽早治疗,有效保障肺小结节患者的健康生活。相关服务直达:肺癌个性化用药解决方案
华测艾普肺癌血清7种自身抗体检测
针对我国人群,自主研发的肺癌7种自身抗体( p 5 3 、G A G E 7 、P G P 9 . 5 、C A G E 、 MAGEA1、SOX2、GBU4‐5)检测,七种自身抗体检测联合胸部CT可提高恶性肺结节阳性预测值和诊断准确率,部分研究结果提示诊断早期肺癌的敏感度高于国际前述研究,也高于临床常用的抗原类肺癌标志物。
参考文献
1. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries[J]. CA Cancer J Clin, 2021, 71(3):209‐249. DOI: 10.3322/caac.21660.
2. Zheng R, Zhang S, Zeng H, et al. Cancer incidence and mortality in China, 2016 [J]. J Nat Cancer Cent, 2022. DOI: 10.1016/j.jncc.2022.02.002.
3. 郑荣寿, 孙可欣, 张思维, 等 . 2015 年中国恶性肿瘤流行情 况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. DOI: 10.3760/cma.j.issn.0253-3766.2019.01.005.
4. Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115‐132. DOI: 10.3322/caac.21338.
5. 孙可欣, 郑荣寿, 曾红梅, 等 . 2014 年中国肺癌发病和死亡 分析[J]. 中华肿瘤杂志, 2018, 40(11): 805-811. DOI: 10.3760/cma.j.issn.0253-3766.2018.11.002.
6.Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003‐15: a pooled analysis of 17 population‐based cancer registries[J]. Lancet Glob Health, 2018, 6(5): e555‐e567. DOI: 10.1016/S2214‐109X(18) 30127‐X.
7. Hong QY, Wu GM, Qian GS, etal. Prevention and management of lung cancer in China[J]. Cancer, 2015, 121 Suppl 17: 3080‐3088. DOI: 10.1002/cncr.29584.
8.Lung CT Screening Reporting & Data System (Lung‐RADS) Version 1.1[EB/OL]. [2022‐10‐06]. https://www. acrorg/Clinical‐Resources/Reporting‐and‐Data‐Systems/Lung‐ Rads.
9. Yang W, Qian F, Teng J, etal. Community‐based lung cancer screening with low‐dose CT in China: results of the baseline screening[J]. Lung Cancer, 2018, 117:20‐26. DOI: 10.1016/j.lungcan.2018.01.003.
10. Yotsukura M, Asamura H, Motoi N, etal. Long‐term prognosis of patients with resected adenocarcinoma in situ and minimally invasive adenocarcinoma of the lung [J]. J Thorac Oncol, 2021, 16(8):1312‐1320. DOI: 10.1016/ j.jtho.2021.04.007.
11.Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol, 2011, 6(2): 244‐285. DOI: 10.1097/JTO.0b013e318206a221.
12. Henschke CI, Yankelevitz DF, Libby DM, et al. Survival of patients with stage I lung cancer detected on CT screening [J]. N Engl J Med, 2006, 355(17): 1763‐1771. DOI: 10.1056/NEJMoa060476.
13. Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7‐30. DOI: 10.3322/ caac.21387.
14. 王鹤,王霄英.2017 Fleischner学会肺小结节指南解读及临床应用要点[J].放射学实践,2017,32(11):1109-1113.
15. 张升雄,时国朝.手术后病理证实为良性肺结节288例 临床病例分析[J].中华结核和呼吸杂志,2021,44(5): 456-461 .
16. 贾金芳,黄静,朱晓莉.肿瘤相关自身抗体对恶性肺结 节的诊断价值[J].中国肿瘤临床,2020,47(6):271-276.
17.MacMahon H, Naidich DP, Goo JM, et al. Guidelines for management of incidental pulmonary nodules detected on CT images: from the fleischner society 2017[J]. Radiology, 2017, 284(1): 228‐243. DOI: 10.1148/ radiol.2017161659.
18. Mori T, Nomori H, Ikeda K, etal. Diffusion‐weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: comparison with positron emission tomography[J]. J Thorac Oncol, 2008, 3(4): 358‐364. DOI: 10.1097/JTO.0b013e318168d9ed.
19. Jiang W, Han Z, Tang X, et al. Diffusion‐weighted imaging diagnostic algorithm in patients with suspected pleural malignancy[J]. Eur Radiol, 2021, 31(12): 9038‐9047. DOI: 10.1007/s00330‐021‐08013‐6.
20.Bai C, Choi CM, Chu CM, et al. Evaluation of pulmonary nodules: clinical practice consensus guidelines for Asia[J]. Chest, 2016, 150(4): 877‐893. DOI: 10.1016/j. chest.2016.02.650.
21. Deppen SA, Blume JD, Kensinger CD, et al. Accuracy of FDG‐PET to diagnose lung cancer in areas with infectious lung disease: a meta‐analysis[J]. JAMA, 2014, 312(12): 1227‐1236. DOI: 10.1001/jama.2014.11488.
22. Li Y, Chen D, Wu X, et al. A narrative review of artificial intelligence‐assisted histopathologic diagnosis and decision‐making for non‐small cell lung cancer: achievements and limitations[J]. J Thorac Dis, 2021, 13(12):7006‐7020. DOI: 10.21037/jtd‐21‐806.
23. Yeh MC, Wang YH, Yang HC, etal. Artificial Intelligence‐Based Prediction of Lung Cancer Risk Using Nonimaging Electronic Medical Records: Deep Learning Approach[J]. J Med Internet Res, 2021, 23(8): e26256. DOI: 10.2196/26256.
会议预告|CTI华测艾研邀您参加第二届单细胞技术及组学应用发展大会
为促进单细胞及组学应用领域的交流与发展,2023年5月19-20日第二届单细胞技术及组学应用发展大会,以“聚焦技术前沿,加速科研转化”为主题,特邀70+行业领袖,1000+专家代表;多形式打造全方位产学研资交流平台,邀请单细胞及组学领域的科学家、企业家、投资人等各界代表共商行业发展。
2023-05-15 18:30:55
提醒!REACH附录XVII拟管控甲醛释放量,现在行动还来得及
2022年5月2日,欧盟委员向世贸组织(WTO)提交了G/TBT/N/EU/888号通报,提议修订(EC) No 1907/2006附录XVII,新增对甲醛和甲醛释放物质的限制条款。该通报案将开展为期60天的公众咨询,建议的通过日期为2022年最后一个季度,并拟于欧盟官方公报发布后第20天生效。此条款管控对象为物品,后续一旦正式管控,将会对众多企业产生影响。
2022-05-09 16:03:54
免疫力|带你了解可以防御“外敌“的免疫基因
免疫力是人体自身的防御机制,可以识别和消灭外来侵入的任何异物(病毒、细菌等),是处理衰老、损伤、死亡、变性的自身细胞和病毒感染细胞的能力。在人体受到外来物刺激之后,免疫系统会被激活,各种免疫相关调控因子介入,使得人体尽快恢复内环境稳定。
2022-05-09 15:53:05
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证

.jpg)
.jpg)