医械产品注册方案 | 输液泵
一、结构组成
主要由控制系统、电机驱动单元、蠕动挤压机构、检测装置、报警装置、输入及显示装置、壳体及其支撑结构、软件组件组成。
产品结构组成中一般是不包含输注管路,但生产企业应在产品研究资料及说明书等相关注册申报资料中详细说明配套输液管路的具体要求。
二、风险等级
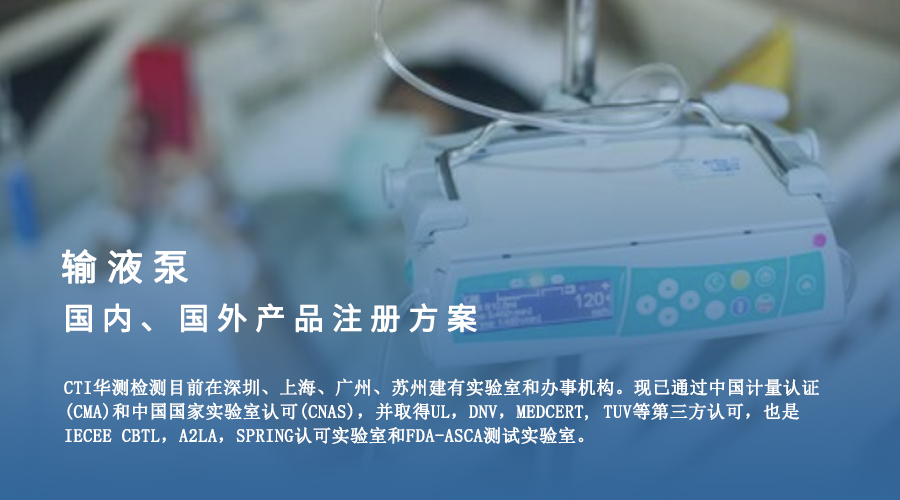
在我国的医疗器械注册管理中,输液泵风险管理类别有II类、III类;
含有贮液装置和输液管路(无菌提供),一般为III类,不含有贮液装置和输液管路,一般为II类。
三、注册单元划分原则
不同的电击防护类型应作为不同注册单元进行注册。如电击防护类型分别为I类、II类输液泵,应按照两个注册单元进行注册。
预期用途相同,性能指标相近,技术结构基本相同的派生系列产品可以划为同一注册单元。例如带药物库输液泵和非带药物库输液泵可以划为同一注册单元
四、产品常见标准
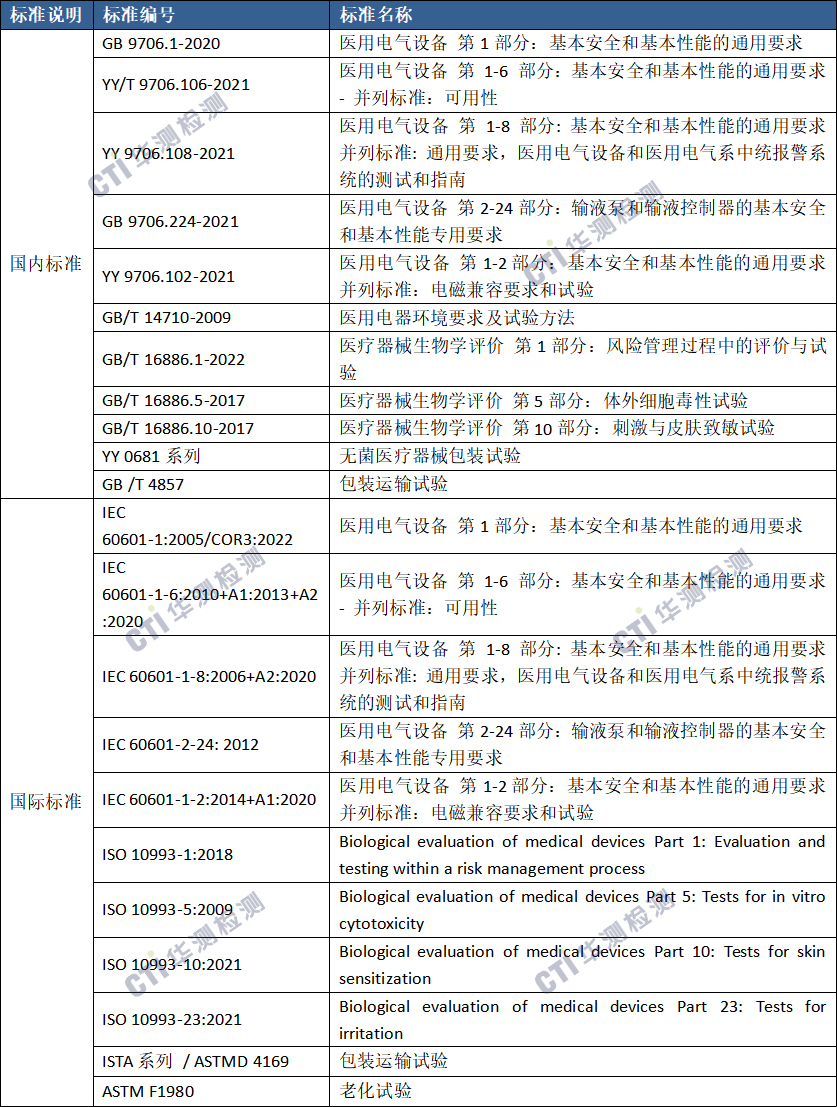
备注:上述标准包括了产品技术要求中经常涉及到的标准;企业需要根据产品的特点引用其他适用的标准。
五、主要技术要求指标
产品的主要技术要求关注点应包括但不局限于以下内容:
1、应明确产品输液模式种类、输液速度的可调范围、步进及误差;
2、应明确输液量的可调范围、步进及误差;
3、应明确KVO、BOLUS速度及误差;
4、应明确快注或快排速度及误差(如有);
5、应明确滴速精度及误差(如有);
6、应明确加温器加温温度范围及误差(如有);
7、应明确产品实时显示的输液量信息;
8、应明确报警功能(网电源中断报警、内部电池耗尽报警(如有)、气泡报警、阻塞报警、完成报警、流速异常报警、滴速异常报警(如有)等);
9、应标明内部电池在产品中速状态下连续工作时间(如有);
10、应明确产品噪音水平dB(A);
11、电气安全、环境实验、电磁兼容等。
华测检测医疗器械实验室目前已经获得了以上大部分测试标准的CNAS、CMA授权,测试项目包括:医疗器械电气安全、电磁兼容、生物相容性测试、包装验证及包装运输等,可以为医疗器械生产企业提供【输液泵】全球市场准入的一站式注册检测服务方案。
正式授牌!华测纽唯牵头设立广州市黄埔区医疗器械行业质量基础设施服务工作站
广州开发区质量强区工作领导小组及广州市黄埔区质量强区工作领导小组办公室于2024年3月26日在广州托思北斗创新基地成功举办了“区级质量基础设施服务工作站”授牌仪式!
2024-03-27 16:50:29
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 08:43:27
CTI华测检测首登天猫健康专场直播
2021年5月13日-16日,第84届CMEF中国国际医疗器械博览会于上海国家会展中心开幕。作为专业的第三方医疗器械检验检测机构,CTI华测检测在上海国家会展中心设置了展位,与前来参会的行业人员热情交流,并首次登上天猫健康联合聚划算官方推出的“家用器械品类日”专场直播,共同发布电子血压计和电子体温计的推优标准,帮助消费者筛选“更精准”的血压计、体温计,以及使用过程中的注意事项等问题。
2021-05-25 14:34:14
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证