医疗器械产品注册方案 | 病人多参数监护仪
多参数监护仪具有复杂和高度集成的功能与模块,是最具代表性的医疗器械之一。通过多种功能模块收集患者的心电、呼吸、血压、血氧饱和度、脉搏、体温等生理信号并进行反馈,为医学临床诊断提供重要的患者信息,并对问题参数及时监督报警。是目前国内临床治疗和监护过程使用的最重要的医疗器械之一。
一、产品分类
多参数监护仪可以根据使用场景进行分类,分为基础多参数监护仪,重症多参数监护仪,手术室专用多参数监护仪,便携式多参数监护仪等:
基础多参数监护仪:基础的多参数监护仪需要至少包括六项指标的监测:心电、呼吸、无创血压、血氧饱和度、脉搏、体温,除此之外可能还有其他功能,模块工作简便高效,追求数据记录的稳定;
重症多参数监护仪:相比基础多参数监护仪,根据患者需要功能更复杂,包括有创血压、呼吸末二氧化碳、呼吸力学、麻醉气体、心输出量(有创和无创)、脑电双频指数等,追求数据记录的灵敏度和精确性;
手术室专用多参数监护仪:与其他监护仪相比更加强调在手术室强电磁干扰环境下的实时监护测量功能;
便携式多参数监护仪:适用于急救转运和野外医疗条件下使用,满足功能需求的同时强调机体的小巧便携性。
除了上述几种分类外,根据患者种类的不同,多参数监护仪还包括:胎儿监护仪、母婴监护仪等。
二、工作原理
与人体直接相连的电极,呼吸管等附件收集人体的生理指标,利用放大器将收集到的生理信息强化并转换为电信号,处理器将收集到的电信号处理,分析,编辑并在显示器中显示或在硬盘中记录、打印,当发现监测数据超过限值时,多参数监护仪的报警系统被触发,通知相关医护人员及时关注患者生理状态。
三、风险管理分类
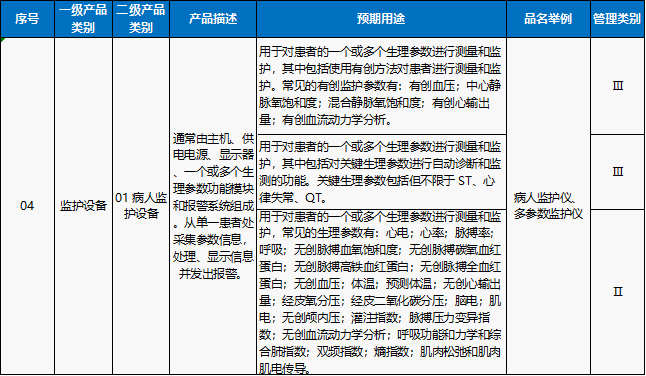
在我国的医疗器械注册管理中:涉及到有创、关键心电信号(ST、QT和心律失常等)的监护仪的风险等级管理类别为Ⅲ类,在无创条件下可以完成参数收集的监护仪的风险等级管理类别为Ⅱ类。
四、注册单元划分原则
注册单元划分应参照《医疗器械注册单元划分指导原则》(国家食品药品监督管理总局通告2017年第187号),对产品的工作原理、结构组成、性能指标等进行综合判定。划分的基本原则如下:
1.一体式病人监护仪与插件式病人监护仪应划分为不同的注册单元。
2.病人监护仪配合使用的设备与病人监护仪应划分为不同的注册单元。
3.病人监护仪与外购的应用部分应划分为不同的注册单元。
五、产品常见标准



六、临床评价路径推荐
根据《医疗器械分类目录》子目录“07医用诊察和监护器械”相关产品临床评价推荐路径:有创监护设备和涉及关键心电信号(ST、QT和心律失常等)的Ⅲ类多参数监护仪为同品种评价路径,Ⅱ类的无创多参数监护设备为免临床评价。


华测检测医疗器械实验室目前已经获得了以上大部分测试标准的CNAS、CMA授权,测试项目包括医疗器械电气安全、EMC、生物相容性测试、材料化学表征、理化及微生物测试、清洗消毒灭菌验证、包装运输及老化实验等,可以为医疗器械生产企业提供【多参数监护仪】全球市场准入的一站式注册检测服务方案。
医械检测领域再提升!华测检测顺利通过CNAS扩项评审!
近日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过中国合格评定国家认可委员会CNAS扩项评审(No. CNAS L1910),并已获得实验室认可证书及认可的检测能力范围附表。
2024-03-11 09:52:17
医疗器械领域再获新突破!| 华测检测CMA扩项获证成功!
2024年2月27日,CTI华测检测有源医疗器械实验室(以下简称“华测医疗器械实验室”)顺利通过国家级CMA资质扩项评审,并已获得资质认定证书及扩项附表。
2024-03-04 08:43:27
CTI华测检测成功入围《深圳市医疗器械优质供应商推荐目录》
深圳市市场监督管理局为贯彻落实深圳市市委、市政府关于产业质量提升的工作部署,着力提升深圳市高端医疗器械产业质量竞争力,推动产业高质量发展,2023年4月11日,深圳市启动了医疗器械产业质量提升“灵渠”计划。
2024-01-22 14:37:44
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证