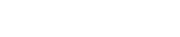产品注册方案 | 有创型血糖仪
目前我国已成为世界上拥有糖尿病患者人数最多的国家,糖尿病已成继心血管疾病和肿瘤之后的第三大非传染性疾病。
而血糖仪作为糖尿病管理的重要部分,可以用于监测糖尿病人血糖控制的效果,反应糖尿病患者糖代谢紊乱的程度,方便后面制定合理的降糖方案、评价降糖治疗效果、指导调整治疗方案等。
一、产品的结构和组成
按其工作原理分为电化学式和光化学式两类产品。一般由检测模块、信号放大模块、AD采集模块、数据处理模块、显示模块、嵌入式软件、信号输出部分(如适用)、电源电路以及按键控制电路等组成。
二、工作原理
血糖仪按工作原理分为电化学式和光化学式两类产品。
电化学法采用检测酶反应过程中产生的电流信号的原理来反应血糖值,酶与葡萄糖反应产生的电子通过电流记数设施,读取电子的数量,再转化成葡萄糖浓度读数。根据电化学法血糖测试条中所采用的酶不同又分为葡萄糖氧化酶(GOD)法和葡萄糖脱氢酶(GDH)法两种类型。

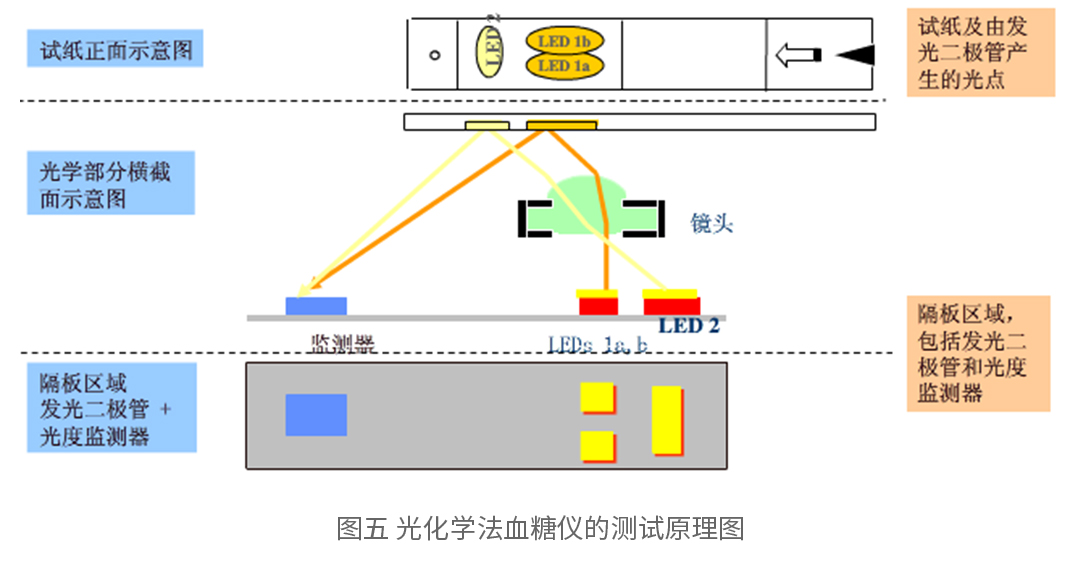
光化学法是检测反应过程中试条的颜色变化来反应血糖值,血糖测试条中所采用的酶一般为葡萄糖氧化酶(GOD),通过酶与葡萄糖的反应产生的中间物(带颜色物质),反应后试纸颜色发生改变,运用检测器检测试纸反射面的吸光度,根据朗伯-比尔定律即可求出血糖浓度。
三、风险管理类别
根据《医疗器械分类目录》,血糖仪的管理类别为Ⅱ类,分类编码为22-02-02;
属于02生化分析设备中的02血糖及血糖相关参数分析仪器。

四、产品注册单元划分
1、产品的基本原理不同,应划分为不同的注册单元。
例:利用电化学法为基本原理的血糖仪与利用光化学法为基本原理的血糖仪应划分为不同的注册单元。
2、性能指标有较大差异的,应考虑划分为不同的单元。
五、产品适用的相关标准

备注:上述标准包括了产品经常涉及到的标准;企业需要根据产品的特点引用其他适用的标准。
六、临床评价路径
《医疗器械注册与备案管理办法》中第三十四条规定:免于进行临床评价的,可以免于提交临床评价资料。免于进行临床评价的医疗器械目录由国家药品监督管理局制定、调整并公布。
血糖仪被列入在《免于进行临床评价医疗器械目录(2023年)》中,属于免于进行临床评价的医疗器械,可以免于提交临床评价资料。

华测检测医疗器械实验室目前已经获得了以上大部分测试标准的CNAS、CMA授权,测试项目包括医疗器械电气安全、EMC、生物相容性测试、材料化学表征、理化及微生物测试、清洗消毒灭菌验证、包装运输及老化实验等,可以为医疗器械生产企业提供【血糖仪】全球市场准入的一站式注册检测服务方案。
正式授牌!华测纽唯牵头设立广州市黄埔区医疗器械行业质量基础设施服务工作站
广州开发区质量强区工作领导小组及广州市黄埔区质量强区工作领导小组办公室于2024年3月26日在广州托思北斗创新基地成功举办了“区级质量基础设施服务工作站”授牌仪式!
2024-03-27 16:50:29
CTI华测检测首登天猫健康专场直播
2021年5月13日-16日,第84届CMEF中国国际医疗器械博览会于上海国家会展中心开幕。作为专业的第三方医疗器械检验检测机构,CTI华测检测在上海国家会展中心设置了展位,与前来参会的行业人员热情交流,并首次登上天猫健康联合聚划算官方推出的“家用器械品类日”专场直播,共同发布电子血压计和电子体温计的推优标准,帮助消费者筛选“更精准”的血压计、体温计,以及使用过程中的注意事项等问题。
2021-05-25 14:34:14
展会邀请丨CTI华测检测与您相约第84届中国国际医疗器械博览会
作为专业的第三方医疗器械检验检测机构,CTI华测将于2021年5月13日-5月16日参加于上海举办的第84届中国国际医疗器械秋季博览会。我们在上海国家会展中心1.2馆 I23, I25, I27 (一楼)等候您的莅临指导。CTI华测与各合作伙伴均专业知识雄厚、经验丰富,将在医疗器械相关领域提供专业技术支持、检测检验及认证一站式服务。我们将与您分享医疗器械最新法规要求,您也将有机会就贵公司相关的业务与CTI华测及各合作伙伴的技术专家进行深入探讨,欢迎前来咨询!
2021-04-29 14:22:02
- 热线电话
- 业务咨询
- 快速询价
- 在线客服
- 报告验证